«Хирургическая профилактика ишемического инсульта у пациентов с заболеваниями магистральных артерий головы и шеи»
Введение
Сосудистые заболевания головного мозга – актуальная медицинская и социальная проблема. Ежегодно в мире переносят инсульт более 6 миллионов человек, из них 400-450 тысяч регистрируется только в России. Инсульт является абсолютно лидирующей причиной инвалидизации населения. Из всех острых нарушений мозгового кровообращения 70% составляет ишемический инсульт. В экономически развитых странах несколько десятилетий тому назад наблюдалась аналогичная ситуация, но вследствие осуществления в государственном масштабе профилактических мер против атеросклероза в этих странах ситуация коренным образом изменилась – смертность от сердечно-сосудистых причин сократилась в 2 раза и более, резко возросла средняя продолжительность жизни населения.
В популяционных исследованиях около 50% ишемических эпизодов, как постоянных, так и временных, являются тромботическими или эмболическими осложнениями атеросклероза артерий большого и среднего калибра, около 25% связано с заболеваниями внутричерепных сосудов малого диаметра, около 20% — с эмболией из сердца, и оставшиеся 5% эпизодов связаны с более редкими причинами (диссекция артерии, артериит, заболевания крови, приводящие к гиперкоагуляционому синдрому, и др.). Атеросклеротическое поражение артерий крупного и среднего диаметра, представляясь наиболее частой причиной ишемических эпизодов, является наиболее значимым объектом хирургического вмешательства или медикаментозного лечения, направленных на профилактику возможных ишемических мозговых катастроф.
Патогенез атеротромботического инсульта.
Атероматозные бляшки поражают главным образом крупные (дуга аорты) и средние артерии, особенно в местах их деления (бифуркация общей сонной артерии), извитости (сифон внутренней сонной артерии (ВСА) или слияния (основная артерия (ОА). Внутричерепные артерии (дистальнее виллизиева круга) страдают от атеросклероза крайне редко, в связи с этим окклюзии этих артерий возникают из-за эмболии чаще, чем из-за локального тромбоза на месте атероматозной бляшки. Такое распределение атеросклеротических бляшек, вероятно, определяется местами гемодинамического напряжения и травмы эндотелия, пограничными зонами разделения потока и застоя крови и турбулентностью, что может вызвать тромбообразование, само по себе ведущее к прогрессированию атероматозного поражения. С ранних стадий своего формирования бляшки осложняются адгезией, активацией и агрегацией тромбоцитов, при этом запускается коагуляция и пристеночный тромбоз. Атеротромботическая бляшка может расти и закупоривать просвет артерии, затем тромб в просвете артерии распространяется проксимально или дистально, тромб может подвергаться лизису посредством фибринолитических механизмов сосудистой стенки и крови. Тромб, или его часть, могут стать эмболом, приводя к закупорке дистальных артерий. Таким образом, эмболы состоят из комбинации холестерина, тромбоцитарных агрегатов и фибрина. В зависимости от состава, размера, плотности и возраста эмболы могут быть лизированы, фрагментированы или по-прежнему закупоривать дистальную артерию и, возможно, запускать локальный антеро- и ретроградный тромбоз. Вероятно, характер и скорость локального кровотока определяют в некоторой степени судьбу эмболов. Возникнет ли при этом инфаркт мозга или нет, зависит от адекватности коллатерального кровотока.
Эмболы переносятся в мозг или глаз по путям нормального артериального кровоснабжения, которое само по себе различно у разных людей. Так, эмбол, образовавшийся в ВСА, обычно попадает в глаз или передние две трети полушария мозга, но может попасть в затылочную долю через заднюю соединительную артерию (ЗСоА). Эмболы могут оказываться в более необычных местах (так, при тяжелом поражении позвоночных артерий (ПА) и низком кровотоке в ОА эмбол, образовавшийся в ВСА, может достигнуть ОА через вилизиев круг). Эмбол может оказаться в противоположном полушарии, достигнув последнее через переднюю соединительную артерию (ПСоА). Возможны и другие «экзотические» варианты миграции эмболов. Наконец, ишемический инсульт на стороне закупоренной ВСА может стать следствием замедленного тока крови в зоне ее кровоснабжения или в пограничной зоне, особенно если коллатеральное кровоснабжение недостаточно.
Атеросклеротическое поражение артерий может и не давать явной клинической симптоматики, обусловливая, тем не менее, несомненную опасность развития церебральных ишемических эпизодов в будущем. Согласно этим клиническим особенностям пациентов с атеросклерозом магистральных артерий головы условно делят на симптомных и асимптомных соответственно.
Каротидная эндартерэктомия или медикаментозная профилактика?
Первая успешная эндартерэктомия была выполнена в США в 1953 году. В последующие десятилетия показания к выполнению каротиднеой эндартерэктомии (СЕА) неуклонно расширялись, количество выполняемых операций стремительно росло. К примеру в 1985 году показания для выполнения СЕА в США были следующими:
1. полушарные ТИА
2. преходящая монокулярная слепота
3. вертебробазилярная недостаточность
4. общая гипоперфузия
5. инсульт с минимальным остаточным дефицитом
6. поражение или комбинация поражений, предрасполагающие к инсульту
Последнее показание было, конечно, эвфемизмом для асимптомных каротидных стенозов. Нестенотические, но тяжело изъязвленные бляшки в области каротидной бифуркации как у симптомных, так и у асимптомных больных, многими ведущими хирургами также рассматривались в качестве подходящего показания для хирургического лечения. В то время обследование практически каждого пациента- кандидата на выполнение СЕА включало традиционную ангиографию, но не были выработаны стандарты для измерения процентов сужения ни диаметра. Было широко распространено убеждение, что 50%-ное сужение диаметра приводило к гемодинамически, и, соответственно, клинически значимому эффекту, предрасполагающему к развитию инсульта, таким образом, подлежащему хирургическому удалению. В дополнение, большинство хирургов, если не все, принимали предпосылку, что риск интраоперационной гипотензии в присутствии каротидного стеноза являлся особенно опасной комбинацией. В результате, асимптомное каротидное поражение рассматривалось и профилактически устранялось у пациентов, подлежащих хирургическому вмешательству на сердце или брюшной аорте. С этими показаниями, к 1985 году, СЕА стала наиболее частой операцией на периферических сосудах, выполняемой в США: более 107000 СЕА было выполнено в нефедеральных медицинских центрах в этот год. В 60-х годах прошлого века нейрохирурги НИИ СП им Н. В. Склифосовского активно занимались проблемой диагностики и оперативного лечения стенотических поражений магистральных артерий головы.
Это огромное и стойко расширяющееся количество операций не ускользнуло от внимания многих лидирующих неврологов. Стали появляться статьи об эффективности и безопасности каротидных операций вообще и у асимптомных пациентов в частности. Несколько значимых сообщений выявили потенциальные изъяны в презентациях, которые подкрепляли общепринятые показания для СЕА. Важной публикацией по этой теме стал обзор Brott and Thalinger о всех СЕА, выполненных в Cincinnati, Ohio в 1984 году. Они выявили неожиданно высокий уровень операционной заболеваемости и смертности (9,5%) и утверждали, что такие результаты хирургического лечения вероятно являются типичными по всей стране, а если так, то есть ли какое либо преимущество у СЕА вообще? Подобные сомнения привели к дизайну, инициации и в конце-концов выполнению нескольких рандомизированных проспективных клинических исследований, направленных на сравнение результатов СЕА и лучшего на тот момент медикаментозного лечения симптомных и асимптомных пациентов. Семь больших исследований, проведенных в Северной Америке и Европе включили три, посвященных симптомным пациентам и четыре – асимптомным. Все исследования были мультицентровыми, проспективными и рандомизированными, однако, имели различные критерии включения и исключения пациентов, различные методы измерения степени стеноза и различные методы доклада результатов. Вопреки этим различиям, выявлено стойкое соответствие в важных исходах всех симптомных исследований и трех из четырех асимптомных исследований.
Сравнению эффективности консервативной и хирургической профилактик ишемического инсульта у больных с симптомными каротидными стенозами посвящены крупные мультицентровые рандомизированные проспективные исследования: North American Symptomatic Carotid Endarterectomy Trial (NASCET) и European Carotid Surgery Trial (ECST) и др. В упомянутых исследованиях сравнивалась эффективность изолированной консервативной профилактики с комбинацией «хирургическая профилактика + консервативная профилактика» у пациентов с различными степенями каротидного стеноза.
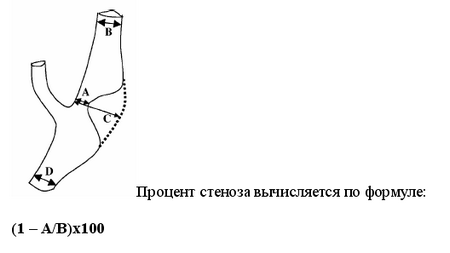
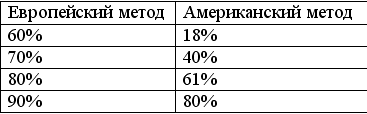
Так как количественные показатели повреждения каротидной зоны стали основным фактором отбора пациентов для оперативного лечения, то, прежде чем перейти к краткому описанию исследований и их результатов, очень важно обсудить методы измерения степени стеноза. Американский метод существенно отличается от европейского метода. Американский метод используется с Extracranial Arterial Occlusive Disease Study в 1950-х, продолжал использоваться в Veterans Administration (VA) Asymptomatic Trial, NASCET, and Asymptomatic Carotid Atherosclerosis Trial (ACAS).
Метод предполагает измерение диаметра просвета в месте наибольшего стеноза (A) при ангиографии и сравнение с диаметром ВСА, дистальнее стеноза, в месте, где стенки ВСА становятся параллельными (B).
степени стеноза по европейской методике предполагает представление гипотетических границ луковицы ВСА, диаметр которой (C) в норме больше просвета ВСА. Степень стеноза вычисляется по формуле:
(1 – A/C)x100
Разница в цифрах одного и того же стеноза наиболее выражена при малых степенях стеноза и становится минимальной при тяжелых стенозах.
Эта разница представлена в таблице:
Рандомизированные исследования, посвященные профилактике ишемического инсульта у симптомных больных.
NASCET
Исследование было задумано с целью проверки гипотезы, согласно которой симптомные пациенты (с полушарными или монокулярными ТИА или предшествующими легкими инсультами) с ипсилатеральным каротидным стенозом (30-99% по методике NASCET) испытают меньше смертельных и несмертельных инсультов после СЕА и медикаментозного лечения, чем пациенты после изолированного медикаментозного лечения. Было запланировано включить в исследование 3000 пациентов и наблюдать их течение 5 лет. Пациенты были разделены на группу тяжелых (70-99%) и умеренных (30-69%) стенозов.
В группе пациентов с тяжелыми стенозами исследование закончилось досрочно: кумулятивный двухлетний риск любого ипсилатерального инсульта в медикаментозной группе составил 26%, а в хирургической группе – 9% (включая периоперационный хирургический риск инсульта). Абсолютное снижение риска составило 17% и относительное снижение риска составило 65%. Риск смертности соответственно в группах составил 12% и 5%. Относительная редукция риска смертности составила 58%.
Эффект каротидной эндартерэктомии на уменьшение риска инсульта или смерти по результатам NASCET

Пациенты с умеренными стенозами (50-69%) продемонстрировали небольшое, но статистически значимое преимущество СЕА, в то время как пациенты с малыми стенозами (30-49%) не выявили преимуществ СЕА.
Такое подавляющее преимущество в группе тяжелых стенозов стало возможным благодаря относительному низкому риску операции. Так, 30-дневный показатель «смерть+инсульт» составил 5,8%. Также было отмечено, что риск развития инсульта в медикаментозной группе выше при увеличении степени стеноза на каждые 10% с 70 до 99. затем было отмечено, что ретинальные ТИА имеют менее плачевный прогноз, чем полушарные в медикаментозной контрольной группе. Так вероятность развития инсульта в течение 2-х лет в группе «ретинальных» пациентов составил 17%, а в группе «полушарных» — 44%.
Также было отмечено, что наличие контралатеральной окклюзии значительно ухудшало прогноз пациентов в медикаментозной группе. При двухлетнем наблюдении 54,6% таких пациентов в медикаментозной группе перенесли инсульт или умерли, а в хирургической группе аналогичный показатель составил всего 20%. Пациенты, включенные в исследование с ТИА в анамнезе, но у которых при КТ головного мозга были выявлены инфаркты, демонстрировали повышенный риск развития ипсилатерального инсульта за время наблюдения (26% против 13%). В последующих публикациях исследователи NASCET отметили, что наличие изъязвления бляшки при ангиографии серьезно осложняет прогноз. Так двухлетний риск развития инсульта у «медикаментозных» больных с изъязвленной бляшкой увеличивался с 26,3% до 73,2% при увеличении степени стеноза с 70% до 99%. Интересно, что риск у пациентов без изъязвления составил 21,3% вне зависимости от степени стеноза. Кроме того, операционный риск у пациентов с и без изъязвления значительно не изменялся.
В феврале 1998 года исследователи NASCET доложили результаты по категории пациентов с умеренными стенозами. Из доклада стало ясно, что пациентов с 50-69% стенозами предпочтительней подвергать СЕА (по результатам 5-тилетнего наблюдения). Однако, разница, хоть и статистически значимая, не была так драматически велика, как в группе тяжелых стенозов. Кроме того, хирургический риск в этой группе был выше и составил 6,7%.
ECST
Начатое в 1981 году, рандомизированное проспективное исследование проводилось под покровительством Medical Research Council of GB. Пациенты были разделены на три категории стенозов: 0-29%, 30-69% и 70-99%, измеренных по европейской методике.
В целом трехлетний риск инсульта у пациентов с тяжелым стенозом (70-99%) составил 21,9% у пациентов, получавших медикаментозную терапию, и 12,3% у пациентов после СЕА. Абсолютное снижение риска инсульта составило 9,6%, а относительное снижение 56%.
Трехлетний риск развития инсульта в группе медикаментозной профилактики у пациентов с тяжелыми каротидными стенозами:
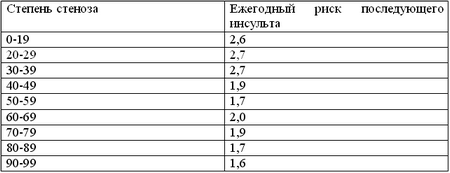
В 1991 году исследователи доложили свои предварительные результаты, совпадающие с американскими. В группе малых стенозов риск развития инсульта был небольшим, и пациентам было рекомендовано медикаментозное лечение. В группе тяжелых стенозов, вопреки 30-тидневному хирургическому риску в 7,5%, отмечалось шестикратное уменьшение риска развития инсульта при применении хирургического метода лечения. Для 778 пациентов, рандомизированных в группе тяжелых стенозов, СЕА практически устранила риск ипсилатерального инсульта в сроки наблюдения. Таблица детализирует средний ежегодный риск ипсилатерального ишемического инсульта, следующего за успешной СЕА.
В 1996 году европейские исследователи доложили результаты наблюдения за группой с умеренными стенозами. Не выявлено значимого преимущества хирургического метода лечения. Однако, не следует забывать о значимой разнице между методиками измерения степени стеноза между Европой и США.
Таким образом, оба исследования, различаясь в тактических деталях, оказались едины в стратегических выводах: при выраженных симптомных стенозах хирургическая профилактика ишемического инсульта имеет несомненные (р<0.001) преимущества перед терапевтическим лечением, демонстрируя значимое снижение риска развития инсульта. Хирургическое лечение пациентов с менее выраженными каротидными стенозами согласно результатам вышеуказанных исследований нецелесообразно.
Рандомизированные исследования, посвященные профилактике ишемического инсульта у асмиптомных больных.
Выбору метода профилактики инсульта у асимптомных пациентов также были посвящены крупные проспективные рандомизированные исследования (Asymptomatic Carotid Atherosclerosis Study – ACAS, Asymptomatic Carotid Surgery Trial - ACST и др.).
ACAS.
ACAS в свое время было великолепным исследованием (хотя на сегодняшний день оно несколько устарело). Оно было основано на оценке исходов 1600 пациентов со стенозами более 60%. В целом, общий риск смерти или инсульта в хирургической группе составил 5,1%, а в медикаментозной – 11%. Это соответствует относительной редукции риска в 50%, однако абсолютной редукции риска только лишь в 5,9%. Другими словами, СЕА уменьшает риск развития инсульта лишь на 1% в год.
Однако, СЕА не предотвращает инвалидизирующие инсульты и она продемонстрировала меньшее преимущество у женщин. Наиболее невероятно то, что в данном исследовании был продемонстрирован обратный рост риска развития инсульта при увеличении степени стеноза в медикаментозной группе:
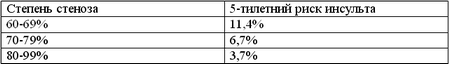
В NASCET была выявлена четкая связь между количеством факторов риска и показателем поздних инсультов в группе пациентов, леченных консервативно. Схожая, но менее выраженная связь была продемонстрирована и при асимптомных артериях.
ACST
ACST – более современное (и на сегодняшний день самое крупное) рандомизированное исследование, посвященное выбору метода профилактики ишемического инсульта у асимптомных больных. Оно было инициировано и проведено под руководством Medical Research Council и UK Stroke Association. 3120 пациентов с каротидными стенозами ≥60% были рандомизированы в хирургичекую группу (50% СЕА были выполнены в течение 1 месяца, 88% — в течение 1 года) и медикаментозную группу. Средний срок наблюдения составил 3.4 года. Критериями исключения стали: высокий риск хирургического вмешательства, ранее выполненная ипсилатеральная СЕА, подозрение на сердечную эмболию. Пятилетний уровень риска инсульта (включая периоперационный инсульт) составил 6.4% в хирургической группе и 11.8% в медикаментозной группе. Уровень риска фатального или инвалидизирующего инсульта: 3.5% и 6.1% соответственно. Уровень риска фатального инсульта: 2.1% и 4.2% соответственно. Выявлено также две особенности: преимущества хирургической профилактики были более выражены у мужчин; не было выявлено статистически значимого преимущества хирургического метода профилактики у пациентов старше 75 лет.
Таким образом, результаты ACAS и ACST выявили значимое (хотя и менее выраженное, чем у симптомных пациентов) преимущество хирургической профилактики у пациентов с асимптомными каротидными стенозами 60-99%.
Характер атеросклеротической бляшки также является значимым фактором: гетерогенные, гипоэхогенные бляшки увеличивают риск развития инсульта у пациента.
Патологическая извитость магистральных артерий головы.
Острая и хроническая недостаточность кровообращения головного мозга может быть обусловлена не только атеросклеротическими стенозами, но и наличием перегибов и петель внутренних сонных и(или) позвоночных артерий.
По данным паталогоанатомических исследований выраженная извитость сонных артерий обнаружена у 30% больных, умерших от ишемического инсульта
1. Извитость сонной или позвоночной артерии с нарушением тока крови и симптомами острого или хронического нарушения мозгового кровообращения в соответствующем сосудистом бассейне считается патологической
2. Форма удлинения
— Извитость — имеются изгибы артерий C и S-образной формы
— Кинкинг — имеются перегибы удлиненных артерий под острым углом (ангуляция)
— Койлинг – имеется удлинение артерий в виде петель и спиралей.
3. Характеристика изгибов
— Без уменьшения просвета
— С сужением просвета в месте изгиба
— С образованием перегородок
Изменение хода артерии приводит к заметным гидродинамическим и гемодинамическим нарушениям:
1. В изгибе локальное давление крови на срезе артерии минимально на внутренней стенке изгиба, прогрессивно увеличивается и достигает максимума на наружной стенке изгиба артерии.
2. Обратно пропорционально локальному давлению изменяется и локальная скорость потоков крови (минимальная у наружного и максимальная у внутреннего радиуса).
3. За счет разницы давления (у наружного и у внутреннего радиуса) возникают стабильные вторичные потоки поперечной циркуляции крови и встречной, имеющие характер завихрения.
4. Резкое внезапное увеличение давления (особенно при гипертоническом кризе) может приводить к гидродинамической закупорке в области изгиба.
5. Суммарные потери энергии при извитости артерии значительны и, соответственно, увеличиваются при эшелонированных извитостях ( так называемые S или Z-образные извитости ).
Заключение.
Таким образом, на сегодняшний день, каротидная эндартерэктомия показана больные с каротидными стенозами 70-99%.
1. асимптомные больные с каротидными стенозами 60-99%
2. симптомные больные со стенозом внутренней сонной артерии более 50%, извитостью позвоночных артерий, патологической извитостью сонных артерий.
Показания к оперативному лечению патологической извитости брахиоцефальных и позвоночных артерий:
1. ишемический инсульт или ТИА в бассейне извитой артерии;
2. ХНМК при отсутствии эффекта консервативной терапии и снижении качества жизни пациента;
3. асимптомные извитости при наличии очаговых изменений на КТ головного мозга;
4. стеноз > 60% в месте перегиба артерии и петлеобразовании.
5. Перепад скорости кровотока в зоне извитости в 2 и более раза по данным доплерографии.
Показания к проведению операции экстра-интракраниального микроанастомоза (ЭИКМА):
1. Окклюзия сонной артерии с клиникой истощения церебрального перфузионного резерва и декомпенсации коллатерального кровообращения, проявляющейся транзиторными ишемическими атаками в бассейне окклюзированной внутренней сонной артерии.
2. Гемодинамически значимый стеноз средней мозговой артерии и тандемные стенозы.
3. Как первый этап хирургического лечения перед КЭАЭ при окклюзии контрлатеральной сонной аретерии.
Показания для реконструкции позвоночной артерии.
1. Пациентам с симптомами нестабильной гемодинамики в вертебро-базиллярном бассейне:
— При стенозе доминантной позвоночной артерии более 75%.
— При стенозирующем процессе той же степени стеноза обеих позвоночных артерий.
— При сегментарной окклюзии второго сегмента позвоночной артерии при наличии гипоплазии другой .
2. Пациентам с клиникой стволовой дисциркуляции тромбоэмболического генеза, при которой выявлен источник эмболии из позвоночной артерии.
3. При значительно влияющей на вертебральный кровоток экстравазальной компрессии (шейное ребро, аномалия Киммерли, унковертебральный артроз и другие спондилогенные причины).
Методика проведения операции каротидной эндартерэктомии.
На настоящий момент существует два основных метода проведения каротидной эндартерэктомии:
1. Классическая каротидная эндартерэктомия с возможным использованием боковой расширяющей ангиопластики заплатой.
2. Эверзионная каротидная эндартерэктомия.
Использование той или иной методики зачастую зависит от личных пристрастий оперирующего хирурга, но в некоторых условиях каждый из методов имеет свои преимущества и является наиболее предпочтительным в конкретной клинической ситуации.
Классическая каротидная эндартерэктомия чаще всего выполняется при:
1. При локализации атеросклеротической бляшки в общей сонной артерии, ее бифуркации и в устье внутренней сонной артерии без пролонгации бляшки на проксимальную и среднюю треть внутренней сонной артерии.
2. В случае достаточного диаметра внутренней сонной артерии (4-5 мм), иначе, без использования расширяющей заплаты высока вероятность возникновения послеоперационного рестеноза внутренней сонной аретрии, что наиболее актуально у женщин.
3. При высоком расположении бифуркации общей сонной артерии.
4. Во время проведения классической каротидной эндартерэктомии не требуется проведение артериолиза по задней поверхности каротидной группы и удаления каротидного тельца, что значительно снижает продолжительность операции и риск повреждения сосудов, находящихся за внутренней и общей сонной артериями – восходящая глоточная и артерия каротидного тельца.
Эверзионная каротидная эндартерэктомия предпочтительна:
1. При наличии сопутствующей патологической извитости внутренне сонной артерии, когда одновременно с каротидной эндартерэктомией возможно выполнить редрессацию внутренней сонной артерии с ее реимплантацией в «прежнее» устье или новое устье на общей сонной артерии.
2. В случае пролонгированной атеросклеротичесокй бляшки, с ее распространением выше устья внутренней сонной артерии.
3. При «узкой» внутренней сонной артерии (диаметр менее 3-4 мм) и высоком риске использования расширяющей боковой заплаты (нагноение заплаты у пациентов с сахарным диабетом).
Условия проведения операции каротидной эндартерэктомии.
Большая часть операций выполняется под многокомпонентным эндотрахеальным наркозом, который значительно повышает устойчивость организма к гипоксии, так же с этой целью используется умеренная контролируемая артериальная гипертензия. После пережатия каротид, артериальное давление поднимается в среднем на 20 мм. Рт. Ст. и равняется приблизительно 140-160/90 мм рт ст.
Системная гепаринизация предохраняет от тромбообразования в пережатых артериях и уменьшает интраоперационную эмболию. Количество гепарина вводится из расчета 100 Ед/кг веса больного.
Схема операции классической каротидной эндаретрэктомии.
Положение пациента на спине с поворотом головы в противоположную от операции сторону. Линия разреза проецируется по переднему краю кивательной мышцы, начинается от сосцевидного отростка и заканчивается на 1-2 см дистальнее яремной вырезки.
Рассекается послойно кожа, подкожная фасция, подкожная мышца.
На пути доступа может встретиться наружная яремная вена, которая перевязывается и пересекается. Мобилизируется передний край кивательной мышцы и он отводится латерально ранорасширителем Андерсона-Эдсона. По мере продвижения вглубь раны латеральная бранша ранорасширителя также вводится глубже, однако медиальную браншу не следует углублять и перемещать, что может вызвать повреждение хрящей гортани.
Сразу под кивательной мышцей расположена внутренняя яремная вена с отходящей от нее общей лицевой веной – ключом к бифуркации общей сонной артерии. Общая лицевая вена пересекается и прошивается, после чего внутренняя яремная вена становится мобильной и легко отводится кнаружи. В этот момент необходимо провести системную гепаринизацию и приступить к скелетированию сонных артерий. Легче всего начать с нижнего угла раны, где расположена Общая сонная артерия.
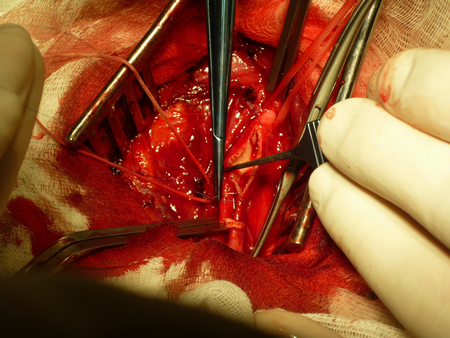
Вскрывается влагалище сонной артерии и выполняется диссекция в продольном направлении, что является безопасным. При приближении к бифуркации ОСА необходимо работать препаровальными ножницами в продольном направлении, дабы не воздействовать грубо артериальную стенку и не вызвать интраоперационную микроэмболию с поверхности нестабильной атеросклеротической бляшки. По мере выделения артерий общая сонная, внутренняя сонная, наружная сонная и верхняя щитовидная артерии берутся на держалки из тонкой тесьмы. Визуально определяются границы распространения атеросклеротической бляшки, внутреннюю сонную артерию необходимо скелетировать дистально на 1 см от верхней границы атеросклеротической бляшки.
Далее проводится проба с пережатием внутренней наружной и общей сонной артерий, во время которой регистрируется кровоток по гомолатеральной средней мозговой артерии методом транскраниальной допплерографии. Если скорость кровотока на уменьшается более чем на 60% от исходной и не становится менее 20 см/сек, то возможно выполнение операции без временного внутрипросветного шунтирования. В противном случае используется шунт. Последовательно пережимаются верхняя щитовидная, внутренняя сонная, общая сонная и наружная сонная артерии. Проводится линейная артериотомия начиная от общей сонной артерии, в области бифуркации до луковицы внутренней сонной артерии.
Визуализируется атеросклеротическая бляшка, определяются ее границы и она отслаивается от неизмененной артериальной стенки. Последовательно производится ее отделение сначала в проксимальных отделах, из устья верхней щитовидной артерии, из наружно сонной и наконец из внутренней сонной артерии, бляшка в ней «сходит на нет». Удаляются остатки интимы, холестерина и кальция, артерия промывается растворами.
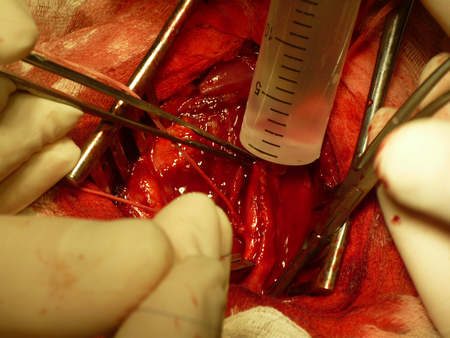
После приступают к наложению непрерывного обвивного шва нитью «Пролен 6-0». Во время ушивания внутренней сонной артерии необходимо отступать от края разреза 0.7-1 мм и каждый последующий вкол иглы осуществлять через 1 мм, по мере приближения к общей сонной артерии можно более «грубо захватывать» в шов артериальную стенку, т.к. диаметр общей сонной артерии достаточно велик и рестеноз в этом месте бывает редко.
После того, как артериотомное отверстие практически полностью ушито, необходимо промыть просвет артерии, проверить ретроградный кровоток из внутренней и наружной сонных артерий, ортоградный кровоток из общей сонной артерии, для удаления тромбов и остатков интимы.
Снова накладывают зажимы на артерии и заканчивают сосудистый шов.
Контролируют методом транскраниальной допплерографии скорость кровотока по гомолатеральной средней мозговой артерии. Снимаю зажимы в следующем порядке. Сначала с верхней щитовидной артерии, затем с наружной сонной артерии, далее с общей сонной артерии (возможные тромботические и атероматозные массы попадают в бассейн наружной сонной артерии) и в конце снимают зажим с внутренней сонной артерии.
Операцию заканчивают последовательным ушиванием соудистого влагалища, подкожной мышцы и клетчатки, кожи.
Для контроля кровотечения оставляют дренаж Редона в межмышечном пространстве.
Статья подготовлена с использованием материалов методических рекомендаций (№ 44) ДЗ г. Москва 2008
«Хирургическая профилактика нарушений мозгового кровообращения экстракраниального генеза».
Составители В.В. Крылов, Е.И. Гусев, В.Л. Леменев, А.В. Воробьев, О.Ю. Нахабин и др.
Почему стоит выбрать именно нас:
- мы предложим самый оптимальный способ лечения;
- у нас есть большой опыт лечения основных нейрохирургических заболеваний;
- у нас вежливый и внимательный персонал;
- получите квалифицированную консультацию по вашей проблеме.